____ LE SOL, UN ÉCOSYSTÈME COMPLEXE ET VIVANT ___
Partie 1
UNE APPROCHE ÉCOLOGIQUE DE L’ANALYSE DES SOLS
L’écologie du sol est l’étude des interactions entre les organismes du sol, et entre les aspects biotiques et abiotiques de l’environnement du sol. Elle s’intéresse particulièrement au cycle des nutriments, à la formation et à la stabilisation de la structure des pores, à la propagation et à la vitalité des agents pathogènes et à la biodiversité de cette riche communauté biologique. Les concepts écologiques sont instructifs pour les études édaphologiques, sur la façon dont les propriétés du sol influencent les communautés végétales naturelles ou cultivées dans une région. La dynamique et la structure des populations dans les communautés végétales dépendent de l’environnement physico-chimique et du réseau trophique du sol qui lui est associé qui se concentre dans la rhizosphère autour des racines des plantes en croissance et dans les détritusphères contenant la litière végétale fraîche et en décomposition. L’activité biologique du réseau trophique plante-sol est contrôlée par des rétroactions positives et négatives qui découlent d’interactions mutualistes, bienveillantes, compétitives, prédatrices et antagonistes. La matrice du sol est agencée avec des pores contenant un mélange air-eau et des solides organisés en agrégats organo-minéraux poreux. La permanence de la structure du sol dépend des processus géomorphologiques et de la pédogenèse. Elle est intrinsèquement dynamique et spatialement hétérogène en réponse aux perturbations environnementales. L’étude du sol appartient au domaine de l’écologie. Notre compréhension des processus complexes du sol est enrichie par son examen dans une perspective écologique.
Intérêt de la perspective écologique
Les écologistes étudient les relations des organismes les uns avec les autres et avec leur environnement physique. Les écologistes considèrent le sol comme un écosystème avec des composants vivants et non vivants qui interagissent les uns avec les autres. Le sol abrite des habitants permanents comme les micro-organismes, les nématodes et les vers de terre ainsi que les plantes, les insectes et les mammifères fouisseurs qui passent tout ou partie de leur vie dans le sol. La diversité génétique, les fonctions physiologiques, la dynamique des populations et la structure des communautés de ces organismes concernent les écologistes. Ces sujets peuvent être étudiés organisme par organisme ou dans le réseau trophique du sol, un cadre décrivant comment l’énergie et les matériaux sont transférés d’un niveau trophique à l’autre dans l’environnement du sol. Les composantes non vivantes de l’écosystème du sol comprennent les roches et les minéraux, la matière organique, l’eau et l’air qui composent la structure physique du sol. La disposition des composants non vivants détermine l’habitat des organismes du sol et leur activité biologique. Ensemble, les composantes biotiques et abiotiques de l’écosystème du sol contribuent aux fonctions écologiques telles que la production primaire nette, les réactions biogéochimiques, les échanges gazeux et le cycle hydrologique. On le voit, le sol relève de l’écologie.
Une perspective écologique enrichit notre perception de la science du sol. Les écologistes s’intéressent à la dynamique spatiale et temporelle des écosystèmes, et aux causes sous-jacentes de cette variation. Les sols du monde sont intrinsèquement variables parce qu’ils se sont formés à partir de processus géologiques complexes à travers des paysages aux influences climatiques et organisationnelles uniques, sur des périodes de temps de durée variables. Devrions-nous limiter notre étude au profil d’un m2 de sol, de sa surface à son substrat rocheux que nous verrions une remarquable hétérogénéité spatio-temporelle de son activité biologique et de sa structure matricielle. En effet, les organismes du sol sont plus abondants et plus actifs près de la surface, des détritus frais, dans les pores bien aérés et autour des racines. Nous expliquons pourquoi ces zones sont des niches privilégiées pour les organismes du sol et comment leur présence dans ces sphères vitales assure le maintien de la structure du sol. Les fluctuations temporelles du sol sont causées par des perturbations dont l’intensité, la fréquence et l’ampleur varient. Une perturbation aussi inoffensive qu’une pluie légère modifie l’équilibre air-eau dans les pores du sol et stimule les processus chimiques, biochimiques et biologiques du sol pendant plusieurs heures. Les feux de forêt, les inondations et les sécheresses prolongées constituent des perturbations intenses qui peuvent modifier la trajectoire des successions temporelles écologique dans l’écosystème du sol pendant des années ou des décennies. Nous reviendrons sur le concept de succession dans le cadre des perturbations, en expliquant comment de tels événements modifient les interactions entre les organismes et les composantes abiotiques du sol.
Les sphères du sol, leur activité biologique et leurs fonctions écologiques
En observant un champ agricole, une prairie ou une zone forestière typique, un écologiste ne pourra pas ne pas relever des variations dans l’état du sol, les communautés végétales, les processus hydrologiques et les échanges gazeux. Cela est dû à une variation à petite échelle des caractéristiques biotiques et abiotiques de l’écosystème qui créent des niches pour les organismes du sol. Les endroits occupés par le plus grand nombre d’organismes du sol sont connus sous le nom de « points chauds » et ils peuvent soutenir plus d’activité biologique aux « moments chauds » dans le temps. Ici, nous décrivons les caractéristiques de trois sphères du sol : la rhizosphère, la détritusphère et la porosphère (Fig. 1).
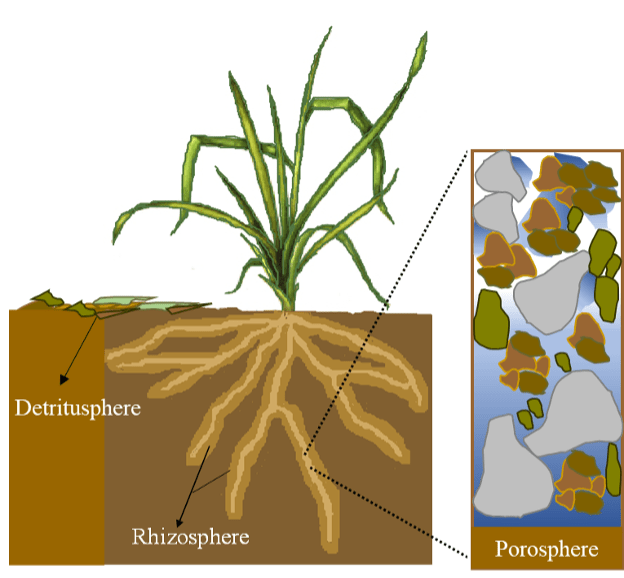
Fig. 1. L’activité biologique du sol est concentrée dans les sphères du sol : dans la rhizosphère autour des racines des plantes, dans les détritusphères contenant des résidus organiques frais, partiellement et bien décomposés, et dans la porosphère, l’espace rempli d’air et d’eau autour des solides du sol (fragments de matière organique, de sable, de limon et d’argile, sous forme de particules distinctes et agglomérés dans les agrégats du sol).
La rhizosphère et son importance écologique
La rhizosphère est la partie du sol qui est en contac directt avec les racines des plantes. La rhizosphère se constitue lorsque le radical primaire émerge d’une graine en germination. La rhizosphère s’étend chaque jour, suivant un schéma diurne. Ainsi, les racines des semis de cresson de Thale (Arabidopsis thaliana) s’allongent à une vitesse de 55–120 μm h-1, le taux d’extension maximal étant d’environ 1 à 2 h après l’aube (Yazdanbakhsh et Fisahn, 2010). Pendant la journée, l’extension des racines ralentit et se stabilise, avec des taux de croissance minimes pendant les 3 dernières heures de lumière du jour et juste après la tombée de la nuit. L’élongation racinaire reprend pendant la nuit, atteignant son apogée le lendemain après l’aube (Fig. 2).
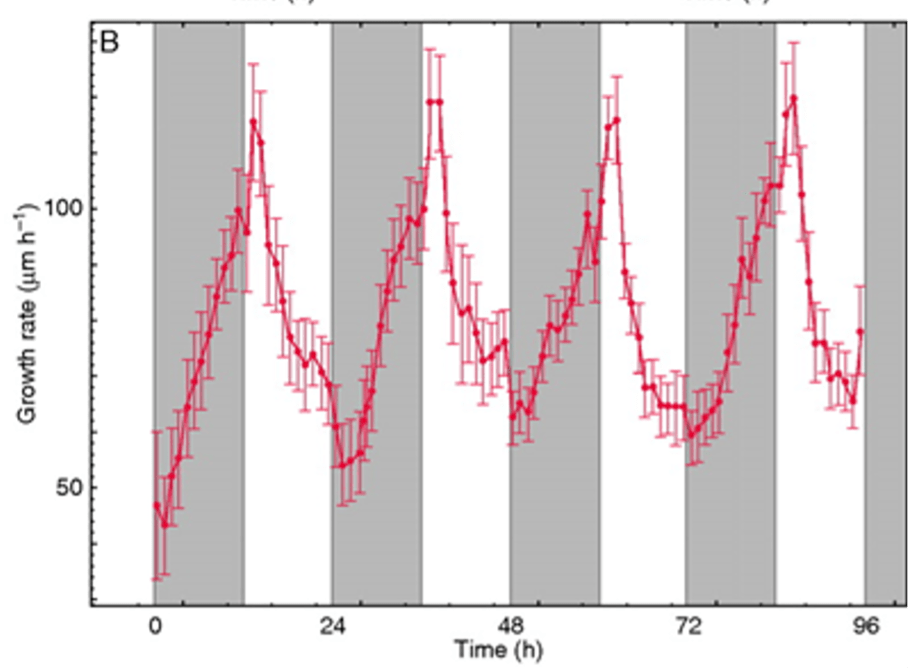
Fig. 2. Profils d’extension racinaire d’Arabidopsis thaliana L. de type sauvage (Col0) poussant à 21 ºC dans des cycles de 12 h de lumière / 12 h d’obscurité. Des plantules de onze jours ont été surveillées pendant 4 jours, et le taux d’extension racinaire moyen (n = 6, avec des barres d’erreur standard) a été calculé à partir du déplacement de l’extrémité de la racine sur des périodes consécutives. Le schéma temporel de la croissance quotidienne des racines montre le taux de croissance minimum après la tombée de la nuit, augmentant pendant la nuit et atteignant un maximum dans les 1 à 2 heures après l’aube, et diminuant progressivement pendant la journée. D’après Yazdanbakhsh N, Fisahn J (2010) Analyse de la cinétique de croissance des racines d’Arabidopsis thaliana avec une résolution temporelle et spatiale élevée. Ann Bot 105(5) :783 à 791. DOI : 10.1093/AOB/MCQ048
L’étendue spatiale de la rhizosphère dépend de l’espèce végétale et des conditions du sol. Dans le désert du Kalahari, le système racinaire de l’arbre du Berger (Boscia albitrunca) s’étend sur >70 m, apparemment pour accéder à l’eau souterraine dans une région qui reçoit <200 mm de précipitations annuelles (Fan et al 2017). Cependant, 95 % des racines des plantes se situent dans la première couche du sol, épaisse de 0 à 40 cm dans le désert de Mojave (Wallace et al, 1980). Les arbustes du désert, y compris l’ Atriplex sp., Lycium sp. et l’Ambrosia dumosa, développent plusieurs racines pivotantes dans les 10 premiers cm et produisent plus de petites racines latérales dans les 10 à 30 cm. La faible profondeur d’enracinement est liée à la rareté des précipitations (~100 mm par an) et à la présence d’une couche de caliche imperméable, à 30–50 cm sous la surface du sol. Outre la barrière physique à l’enracinement causée par le compactage du sol et les couches rocheuses, les racines évitent également de pousser dans les zones du sol gorgées d’eau. Les racines des plantes ont besoin d’oxygène pour la respiration cellulaire. Or une pression d’oxygène sol-air <10 kPa inhibe l’extension des racines (Sønderholm et Bjerrum 2021). Les racines détectent également les gradients chimiques dans l’environnement, ce qui les amène à proliférer dans les couches de sol au pH favorable, à faible teneur en sel et aux concentrations en quantité suffisante de nutriments. Certaines plantes produisent des racines en grappes. Un certain nombre de radicelles s’agrègent en groupes pour se développer de manière coordonnée pour faire face aux faibles concentrations de phosphore, d’azote et de fer dans la rhizosphère (Shane et Lambers, 2005). Une fois qu’un amas s’est formé, il libère des carboxylates à un rythme très rapide, solubilisant le phosphate et d’autres ions pour augmenter les quantités absorbées par les racines (Fig. 3).

Fig. 3. Racines composées de Banksia grandis cultivées dans un système hydroponique avec un apport en phosphate extrêmement faible (≤1 μM). Les jeunes racines en grappes en développement (flèche noire) sont moins denses que les racines en grappes matures plus âgées (flèche blanche). La barre blanche mesure 20 mm de long. De Shane MW, Lambers H (2005) Racines du cluster : une curiosité en contexte. Plant Soil 274:101-125. DOI : 10.1007/S11104-004-2725-7
La rhizosphère est un environnement unique qui attire et favorise la croissance d’un plus grand nombre d’organismes du sol que le sol environnant. Certains organismes atteignent la rhizosphère passivement. L’eau qui s’écoule vers la racine en raison de l’évapotranspiration transporte des cellules bactériennes dormantes, des spores fongiques et des protistes et nématodes enkystés et les dépose à la surface des racines. Une telle dispersion passive est courante, puisque, jusqu’à 80 % des cellules microbiennes du sol sont dormantes à tout moment (Blagodatskaya et Kuzyakov 2013). Les communautés bactériennes du sol qui se dispersent dans des environnements riches en substrat sont plus résilientes que celles qui ne le font pas (Sorensen et Shade 2020). Les racines libèrent une multitude de substrats organiques dans la rhizosphère. Les substrats comprennent des débris cellulaires et des mucilages qui sont physiquement abrasés lors de l’extension des racines et des molécules comme les acides organiques, les composés phénoliques, les peptides, les vitamines et les hormones qui sont synthétisées et sécrétées pour attirer et nourrir les organismes du sol. Cette rhizodéposition représente un flux net de carbone de la racine de la plante vers le sol qui représente 17 à 40 % du carbone total provenant de la photosynthèse pendant la durée de vie de la plante (de la Fuente Cantó et al 2020), avec une plus grande proportion de photosynthétats allouées aux racines des plantes plus jeunes qu’aux plantes plus âgées aux plantes stressées en raison de conditions météorologiques défavorables, d’herbivorie et d’ agents infectieux.
Les molécules de signalisation sont une classe d’exsudats racinaires qui agissent comme des substances chimiques infrarouges permettant aux microorganismes et à la faune du sol de détecter la présence de racines. Les signaux échangés entre les racines et la faune du sol créent le rhizobiome, une communauté d’organismes qui vivent sur les surfaces racinaires externes et internes. Les plantes peuvent délibérément synthétiser et sécréter des composés spécifiques qui sélectionnent et assemblent le rhizobiome (Bever et al., 2010). Cette interaction est bien décrite pour les plantes associées à des bactéries qui catalysent la fixation biologique de l’azote (N2), une réaction qui utilise le N2 de l’atmosphère avec de l’énergie, de l’eau et des ions H+ pour produire de l’ammoniac (NH3) et de l’hydrogène gazeux (H2) :
N2 + 16 ATP + 16 H2O + 8e- + 8H+ —-> 2NH3 +H2 + 16ADP + 16Pi [1]
Les bactéries capables de cette réaction possèdent l’enzyme nitrogénase, une protéine catalytique molybdène-fer (MoFeP) et une protéine de fer réductrice (FeP) qui complètent les processus de transfert d’électrons et de protons par des changements conformationnels dans le complexe FeP-MoFeP dépendant de l’ATP.
Chez les légumineuses de la famille des Fabacées, la fixation biologique de N2 se produit dans les nodules racinaires occupés par le symbiote bactérien et les rhizobiums appartenant aux genres Rhizobium, Bradyrhizobium ou Ensifer (également appelé Sinorhizobium). La base génétique de la symbiose légumineuse-rhizobium est résumée pour la légumineuse modèle Medicago truncatula (Gautrat et al, 2021) Les racines déficientes en azote de M. truncatula produisent une hormone peptidique de la famille des peptides codés en C-terminal (CEP) qui est perçue dans les pousses par le récepteur Compact Root Architecture2 (CRA2). Cette voie combinée de pousses racinaires contrôle la longueur de la racine primaire et détermine l’étendue du développement radiculaire latéral, influençant également l’angle de croissance des racines latérales à partir de la racine primaire. Les rhizobiums dans la rhizosphère déclenchent une voie de signalisation de la cytokinine reconnue par le récepteur de la cytokinine CRE1 et le facteur de transcription Nodule Inception qui initient la nodulation. La voie des rhizobiums interagit avec les signaux échangés par CEP-CRA2, conduisant à la nodulation lorsque la concentration en nitrate (NO3−) dans le sol est suffisamment faible (Gautrat et al 2021). Ces contrôles génétiques font de la symbiose légumineuse-rhizobium un moyen très efficace de répondre aux besoins en azote des légumineuses à grains comme le lupin, le pois chiche, la lentille et le haricot, qui obtiennent 41 à 71 % de l’azote nécessaire pour produire de la biomasse aérienne à partir de la fixation biologique du N2 (Palmero et al 2022).
Interaction bienveillante entre les plantes et les bactéries
Les plantes non légumineuses bénéficient également de la fixation biologique de N2 par les endophytes racinaires (bactéries qui deviennent résidentes dans les tissus racinaires et y vivent au moins une partie de leur cycle de vie, sans provoquer de maladie) et les bactéries libres associées aux racines. Connues collectivement sous le nom de diazotrophes, ces bactéries fixatrices N2 non symbiotiques ne forment pas de nodules mais possèdent un gène nifH fonctionnel qui code pour l’enzyme nitrogénase. Les diazotrophes endophytes racinaires ont été détectés pour la première fois dans la canne à sucre dans les années 1970 (Gluconacetobacter spp., anciennement Acetobacter diazotrophicus). D’autres découvertes dans les années 1980 ont révélé que l’Azospirillium vivait à l’intérieur des racines du blé et du sorgho (Sorghum spp.). Depuis lors, des centaines de bactéries et d’archées ont une capacité de fixation de N2 dans les graminées cultivées (famille des Poacées, anciennement connues sous le nom de Gramineae). Certaines variétés de canne à sucre tirent jusqu’à 70 % de leurs besoins en azote de la fixation biologique de N2 grâce à leur association avec Gluconacetobacter diazotrophicus. Le riz, le blé, l’orge et d’autres céréales obtiennent également de l’azote pour les processus métaboliques des diazotrophes qui colonisent leurs racines, leurs tiges et leurs feuilles. Les premiers relevés des diazotrophes ont été effectués sur des milieux de croissance sélectifs et limités en N. Les progrès récents de la métagénomique améliorent notre capacité à détecter les organismes fixateurs de N2 possédant le gène nifH. Par exemple, le riz soutient les diazotrophes avec des séquences nifH des alphaprotéobactéries (Thiobacillus-like, Methylocystis), betaproteobacteria (Azoarcus, Azovibrio, Herbaspirillum), deltaprotéobactéries (Desulfovibrio), gammaprotéobactéries (Klebsiella-like, Azotobacter, Geobacter sulfurreducens) et les Firmicutes (apparentés à Clostridium et Heliobacterium). Dans le sorgho, les diazotrophes protéobactériens présentaient des séquences nifH liées aux bactéries des ordres Bacillales, Burkholderiales, Diazotrophes, Enterobacteriale, Rhizobiales, Rhodospirillales et Sphingomonadales (Rosenblueth et al 2018). Bien que les cultures céréalières, par leurs interactions avec les endophytes racinaires, aient le potentiel d’acquérir du N2 dans l’atmosphère, elles ne fournissent pas suffisamment d’azote pour atteindre les objectifs de rendement en grains. Les recherches en cours sur les partenariats entre les plantes diazotrophes et les plantes aident les agriculteurs à comprendre comment les endophytes racinaires fixateurs de N2 peuvent être utilisés pour répondre aux besoins nutritionnels des cultures céréalières.
Outre l’interaction bipartite bienveillante entre les plantes et les bactéries fixatrices de N2, la rhizosphère est l’hôte d’interactions multitrophiques complexes (Fig. 4). Les bactéries et les champignons attirés par la surface des racines ou colonisant les tissus racinaires sous forme d’endophytes, y compris les champignons mycorhiziens, font partie du réseau trophique du sol. Les bactéries (consommateurs primaires) se fixent et prolifèrent généralement sous forme de biofilms en utilisant des substrats libérés par l’épiderme racinaire. Les champignons mycorhiziens arbusculaires sont des endophytes racinaires et des symbiotes racinaires obligatoires pour la majorité des plantes terrestres, également considérées comme des consommateurs primaires en raison de leur dépendance aux photosynthétats (de 15 à 30 % de la production primaire nette sont transférés des racines aux champignons mycorhiziens) ; Chapin et Eviner, 2014). Les nématodes qui se nourrissent des racines sont également considérés comme des consommateurs primaires car ils tirent leur nutrition directement des tissus racinaires. Les consommateurs secondaires pourraient être des bactéries fongitres, telles que celles qui se développent dans les biofilms à la surface des champignons mycorhiziens arbusculaires, comme illustré pour Rhizoglomus irregulare colonisé par Burkholderia anthina (Fig. 4 ; Taktek et al, 2017). Les consommateurs secondaires peuvent utiliser des antibiotiques, d’autres inhibiteurs de croissance ou des composés toxiques pour arrêter la croissance fongique, ou ils peuvent infecter des champignons avec des virus qui provoquent une lyse cellulaire. Les consommateurs tertiaires sont les protistes prédateurs et les nématodes (p. ex. nématodes bactérivores et fongibres) qui se nourrissent en engloutissant, écrasant ou aspirant le cytoplasme des cellules bactériennes et fongiques endommagées. Ces interactions peuvent être positives ou négatives pour le réseau trophique du sol. Pour les consommateurs primaires, l’exsudation des racines favorise une croissance microbienne rapide (rétroaction positive), mais la surface des racines est un espace fini et la concurrence entre diverses populations pour les ressources provoquera une rétroaction négative qui régule la taille du rhizobiome. D’autre part, la prédation par les consommateurs tertiaires semble être une rétroaction négative, car elle élimine la biomasse microbienne. Cependant, la prédation peut agir comme une rétroaction positive, car l’élimination de la biomasse microbienne plus ancienne permet le rajeunissement de la population microbienne avec des cellules plus jeunes et biologiquement actives. La prédation peut également éliminer les agents pathogènes potentiellement infectieux des plantes avant qu’ils ne causent des maladies des plantes. Ainsi, la rhizosphère est un point chaud où les plantes interagissent avec des organismes du sol bienveillants et antagonistes dont les activités sont orchestrées, en partie, par les relations trophiques dans le réseau trophique du sol.
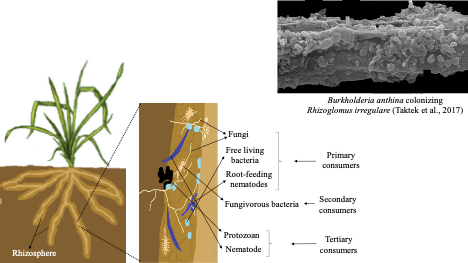
Fig. 4. Réseau trophique du sol, montrant les consommateurs primaires (bactéries, champignons, nématodes racinaires) et les groupes trophiques supérieurs, y compris les consommateurs secondaires (bactéries fongibres) et les consommateurs tertiaires (protozoaires, nématodes). La photographie est une micrographie électronique à balayage de la matrice bactérienne de Burkholderia anthina formée sur les hyphes du champignon mycorhizien Rhizoglomus irregulare, illustrant les exopolysaccharides comme des couches horizontales et des cellules bactériennes en forme de cocci du biofilm, recouvrant les hyphes fongiques. D’après Taktek S, St-Arnaud M, Piché Y, Fortin A, Antoun H (2017) Solubilisation de roches phosphatées ignées par des mycorrhizobactéries et des hyphobactéries formant un biofilm associées à Rhizoglomus irregulare DAOM 197198. Mycorhize 27:13-22. DOI : 10.1007/S00572-016-0726-Z
La détritusphère et son importance écologique
La détritusphère est la couche de litière morte et en décomposition provenant des plantes. Dans les écosystèmes agricoles et forestiers et les prairies., La détritusphère est formée par les résidus qui restent après la récolte ou par le dépôt naturel de feuilles, de tiges et de débris ligneux sénescents à la surface du sol. Lorsqu’elle n’est pas perturbée par la machinerie et les activités humaines, la détritusphère forme un horizon O distinct contenant de la litière non décomposée, partiellement ou fortement décomposée (feuilles, aiguilles, brindilles, mousses et lichens) au-dessus des horizons de sol minéral. Les animaux de pâturage qui mangent des plantes et défèquent les fibres non digestibles à la surface du sol augmentent le volume de la détritusphère. Les humains font de même en épandant du paillis, du compost, des boues d’épuration et des résidus urbains qui contiennent tous des résidus végétaux frais ou décomposés au moment de l’application. Que ces résidus soient laissés à la surface du sol ou enfouis dans le profil du sol, la litière végétale est un substrat attrayant pour les organismes du sol, car elle est humide, riche en matière organique et en éléments nutritifs.
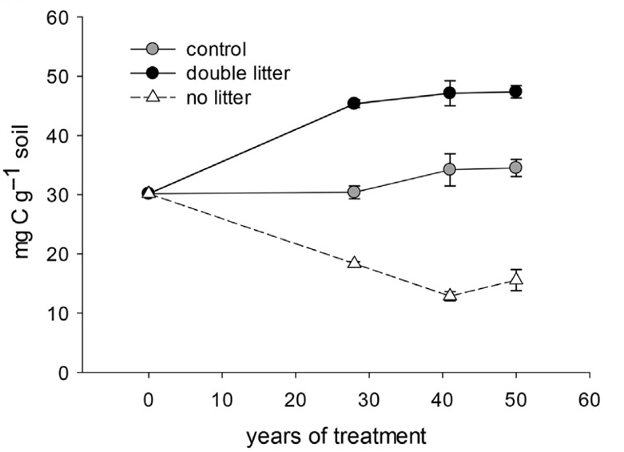
Fig. 5. Concentration en carbone organique du sol (sol mg C g-1) dans l’horizon de 0 à 10 cm (A) de Noe Woods, Arboretum de l’Université du Wisconsin, États-Unis. Des traitements expérimentaux ont été mis en place en 1956 et mesurés en 1984, 1997 et 2006. Le témoin a reçu les apports naturels de litière au-dessus et au-dessous du sol, mais les débris ligneux grossiers (>1 cm de diamètre) ont été enlevés, et les semis et le matériel herbacé ont été enlevés. La litière double a reçu les feuilles ou les aiguilles au-dessus du sol qui ont été recueillies dans les parcelles sans litière. Le traitement sans détritus consistait à éliminer les apports aériens pendant la sénescence automnale et périodiquement tout au long de l’année. Les valeurs sont la moyenne ± 1 erreur type (n = 4). D’après Lajtha K, Bowden RD, Crow S, Fekete I, Kotroczó I, Plante A, Simpson MJ, Nadelhoffer KJ (2018) Le réseau de traitement d’entrée et d’élimination des détritiques (DIRT) : aperçu de la stabilisation du carbone dans le sol. Sci Total Environ 640-641:1112-1120. DOI : 10.1016/j.scitotenv.2018.05.388.
Les apports de litière contribuent au cycle biogéochimique du sol, car les organismes du sol utilisent les substrats organiques complexes contenus dans les résidus végétaux pour l’énergie et la nutrition. La quantité de litière retournée au sol chaque année est plus importante dans les biomes où la production primaire nette est plus élevée (p. ex. les forêts tropicales et les prairies) que dans les écorégions où la production de biomasse végétale est moindre. En général, les détritus proviennent de la litière (environ 10 à 30 % de la production primaire nette), mais comprennent également les apports racinaires provenant de la rhizodéposition et du renouvellement des racines fines, soit 10 à 40 % supplémentaires de la production primaire nette (Chapin et Eviner 2014). La litière végétale qui pénètre dans la détritusphère fait partie du cycle biogéochimique du sol, mais elle est également essentielle pour maintenir la matière organique du sol et reconstituer la fertilité du sol à long terme. Le projet DIRT (Detrital Input and Removal Treatment) sur des sites forestiers et de prairies aux États-Unis illustre l’importance des apports de litière végétale pour maintenir le niveau de carbone dans le sol. Le doublement des apports de litière aérienne (Double Litter) a augmenté de 1,5 fois la concentration de carbone organique du sol dans la couche de 0 à 10 cm après 30 ans, tandis que l’exclusion de la litière aérienne (No Litter) a réduit le carbone organique du sol de 50 % après 30 ans (Fig. 5). Des réductions similaires du carbone organique du sol se produisent lorsque les racines sont exclues ou lorsque la litière aérienne et les racines ne sont pas remises dans le sol (Lajtha et al 2018). La restitution de la litière végétale au sol permet de maintenir le carbone organique du sol, mais n’entraîne pas nécessairement un gain linéaire en matière de piégeage du carbone, car la minéralogie du sol et les processus microbiens influencent la quantité de carbone retenue dans le système sol-plante.

Fig. 6. Dépôt de vers de terre créé par Lumbricus terrestris L. Les vers de terre collectent la litière végétale et l’enterrent partiellement dans la couche de sol minéral, laissant une surface de sol relativement nue autour du tertre dans les agroécosystèmes en culture annuelle. Photo des auteurs.
La dynamique de la matière organique dans le détritusphère est également déterminée par les propriétés physiques et chimiques de la litière végétale. Les apports frais sont des morceaux grossiers et intacts de feuilles, de tiges, de branches et de racines latérales dont la taille doit être physiquement réduite pour accroître la décomposition.. Les invertébrés du sol comme les termites, les fourmis et les vers de terre mâchent, déchirent et délogent des fragments de débris végétaux. Ces fragments sont souvent collectés et stockés dans les nids ou les terriers de ces animaux, où ils sont partiellement enfouis par les minéraux du sol et colonisés par les micro-organismes du sol (Fig. 6). Une fois partiellement décomposés, les résidus organiques sont consommés et redistribués par la macrofaune et la mésofaune du sol, y compris les acariens, les collemboles et d’autres insectes. Ces organismes sont considérés comme des ingénieurs dans le réseau trophique du sol, car ils mettent des substrats organiques à la disposition des consommateurs primaires. La décomposition mécanique de la litière végétale fraîche libère des ions solubles et des sucres qui étaient contenus dans les tissus conducteurs et les vacuoles des cellules. Ces substrats facilement métabolisables soutiennent la croissance des consommateurs primaires qui produisent des enzymes hydrolytiques pour dégrader les polymères végétaux complexes (cellulose, hémicellulose, lignine, phospholipides, cutine, subérine, protéines et autres). Selon la composition chimique des détritus, il peut s’écouler des mois, voire des années, avant que ces macromolécules ne soient hydrolysées en substrats métabolisants, notamment des monosaccharides simples, des acides gras, des peptides et des ions qui sont métabolisés pour la biosynthèse de nouveaux micro-organismes et de tissus végétaux et animaux (Fig. 7).
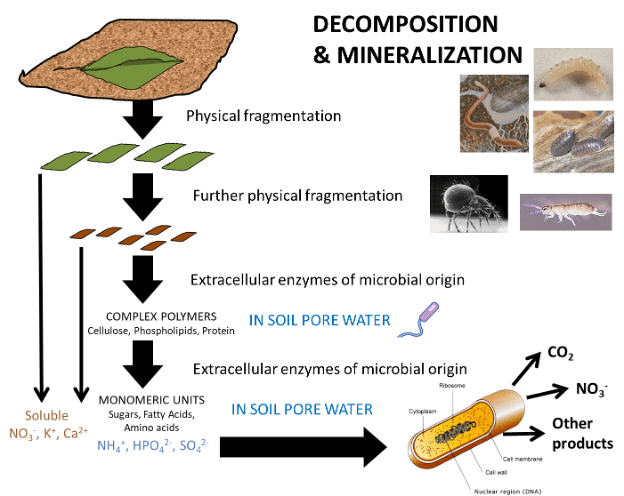
Fig. 7. Décomposition de la litière végétale dans l’écosystème du sol. La litière, représentée par une feuille sénescente, est fragmentée physiquement sous l’action de la macrofaune et de la mésofaune du sol. Après la rupture des parois cellulaires végétales, des ions sont libérés des vacuoles et des molécules organiques complexes comme la cellulose, la lignine et les protéines pénètrent dans l’eau interstitielle du sol. Les enzymes extracellulaires produites par les micro-organismes du sol hydrolysent les composés complexes en unités monomères simples comme les sucres, les phénols, les acides aminés et les ions. Les monomères et les ions sont ensuite absorbés à travers la membrane cellulaire des procaryotes (illustrés) et des eucaryotes (non illustrés), où ils sont métabolisés par la respiration (CO2), en d’autres formes ioniques (par exemple, NO3- produit par l’oxydation de l’ammoniac et la nitrification) et d’autres sous-produits métaboliques, tels que les exopolysaccharides pour la formation de biofilms.
Par conséquent, la perte de masse lors de la décomposition de la litière végétale est liée à sa chimie, où les résidus à faible teneur en lignine se décomposent plus rapidement. La décomposition est accélérée par l’ajout d’engrais azoté (Fig. 8 ; Hobbie, 2000).
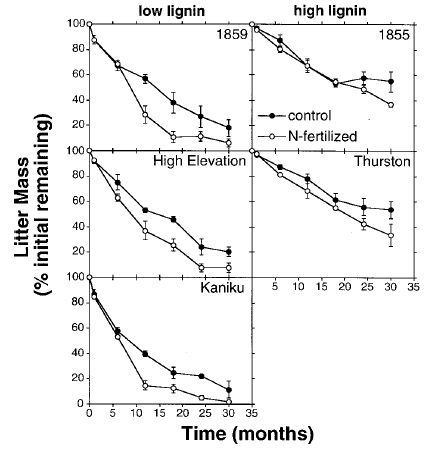
Fig. 8. Décomposition (pourcentage de la masse initiale restante) de trois types de portée de Metrosideros polymorpha à faible teneur en lignine et de deux types à haute teneur en lignine . La litière de feuilles sénescentes a été pesée dans des sacs à litière (100 cm2 fabriqués à partir d’une moustiquaire en fibre de verre de 1 mm) et placée dans des traitements de contrôle et de fertilisation azotée d’une forêt humide montagnarde près du tube de lave de Thurston, dans le parc national des volcans d’Hawaï, aux États-Unis. La teneur en lignine de bromure d’acétyle de la litière de feuilles a conduit à leur classification en lignine faible : 116 g kg-1 (flux de 1859), 131 g kg-1 (haute altitude), 105 g kg-1 (Kaniku) ; ou riche en lignine : 182 g kg-1 (flux de 1855) et 214 g kg-1 (Thurston). D’après Hobbie S (2000) Interactions entre la lignine de la litière et la disponibilité de l’azote du sol lors de la décomposition de la litière de feuilles dans une forêt montagnarde hawaïenne. Écosystèmes 3:484-494. DOI : 10.1007/s100210000042.
La litière de feuilles dans la détritusphère sert également de modèle pour la succession écologique. Les communautés fongiques décomposeuses présentent des modèles d’assemblage similaires à ceux des communautés végétales et animales, où différentes espèces deviennent dominantes à différents moments dans le temps (Fig. 9). On observe que des espèces fongiques étroitement apparentées ayant des fonctions similaires deviennent dominantes au même stade de décomposition, quel que soit l’habitat. En règle générale, les champignons de l’Ascomycète sont plus abondants aux premiers stades de la décomposition de la litière de feuilles et les champignons du Zygomycète deviennent numériquement dominants aux derniers stades de la décomposition (Vivelo et Bhatnagar 2019). Les facteurs affectant la succession fongique étaient le stade de pourriture, le type de litière végétale et le climat. La préférence fongique pour la croissance sur la litière de feuilles en décomposition dépend de leur phylum et de leur classe, plutôt que d’une classification taxonomique plus fine (p. ex. genre), ce qui suggère que la succession fongique est liée à une réponse généralisable aux ressources et aux niches climatiques (Vivelo et Bhatnagar 2019). Étant donné que la succession fongique est l’un des modèles les plus répandus et les plus universels d’assemblage et d’activité des communautés en écologie des écosystèmes, la compréhension des principales caractéristiques taxonomiques et biologiques de ce processus donne un aperçu des flux d’énergie et de carbone dans la détitusphère.
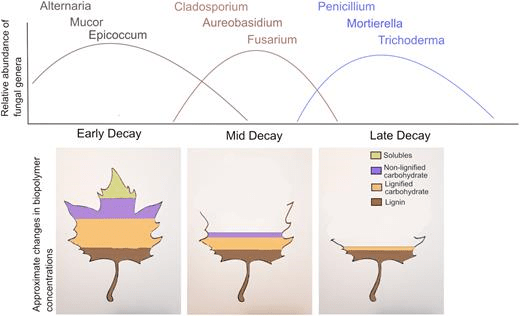
Fig. 9. Changements hypothétiques dans la composition de la communauté de décomposeurs fongiques pendant la décomposition de la litière. La concentration des biopolymères végétaux change à mesure que les produits chimiques de la litière labile (c’est-à-dire les glucides solubles) se dégradent plus rapidement que les matériaux récalcitrants (c’est-à-dire la lignine, les tanins condensés, les cires et les composés phénoliques). Les lignes sur le graphique de l’abondance relative représentent la variation de l’abondance relative des genres correspondants codés par couleur. D’après Vivelo S, Bhatnagar JM (2019) Un signal évolutif de la succession fongique pendant la décomposition de la litière végétale. FEMS Microbiol Ecol 95(10) :fiz145. DOI : 10.1093/femsec/fiz145
La porosphère et son importance écologique
Le sol est un milieu poreux dynamique, ce qui signifie que sa structure physique, les réactions chimiques et l’activité biologique dépendent de l’arrangement des solides et des vides dans la matrice. Les vides du sol sont souvent appelés porosphère, c’est-à-dire les pores et leur connectivité dans un volume de sol tridimensionnel. Les plus petits pores du sol sont les nanopores (jusqu’à 100 μm de diamètre) et les micropores (<10 μm de diamètre), tandis que les cavités de plus de 75 μm de diamètre sont désignées comme macropores. Les pores existent à l’intérieur des agglomérats, tels que l’espace interstitiel des microagrégats (organo-minéraux <250 μm de diamètre), appelé agrégatosphère. Nous avons choisi de définir tous les pores comme faisant partie de la porosphère (Fig. 10) parce que les pores ont des caractéristiques générales et des rôles en fonction de leur taille. Par exemple, les macropores sont responsables de l’écoulement préférentiel de la solution du sol et du transport rapide des solutés et des colloïdes. L’infiltration et le drainage de l’eau se produisent plus rapidement à travers les macropores que les autres types de pores, et l’écoulement latéral de l’eau dans les horizons de sol minéral dépend de la connectivité des macropores.
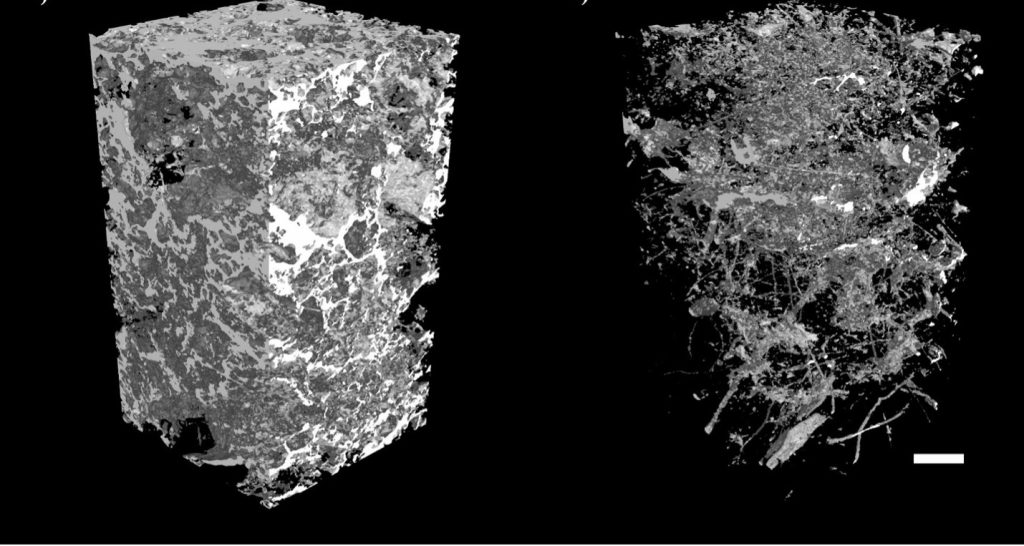
Fig. 10. La porosphère des profils de sol (0-20 cm) des champs adjacents sous production de blé (Triticum aestivum L.) dans les Midlands de l’Est, au Royaume-Uni. À gauche, un sol labouré annuellement à une profondeur de 20 à 25 cm. À droite, un sol non labouré a été planté avec un semoir et n’a pas été cultivé pendant au moins 5 ans. La visualisation de l’espace poreux met en évidence la forte connectivité et les pores plus petits dans le sol labouré, par rapport à la présence de nombreux biopores dans le sol non labouré. Barre d’échelle =10mm. Tiré de : Mangalassery S, Sjögersten S, Sparkes D, Sturrock CJ, Craigon J, Mooney SJ (2014) Dans quelle mesure le semis direct peut-il entraîner une réduction des émissions de gaz à effet de serre des sols tempérés ? Sci Rep 4:4586. DOI : 10.1038/srep04586
La vie biologique dans le sol existe dans les pores. Les racines des plantes s’étendent dans les mésopores (de 10 à 75 μm de diamètre) et exercent une pression qui les élargit en macropores à mesure que les racines poussent axialement et radialement dans le profil du sol. Du fait de leur petite taille, les micro-organismes du sol vivent dans les micropores (<10 μm de diamètre), dont certains sont également habités par les consommateurs tertiaires (microfaune du sol : protistes, nématodes) en fonction de leur taille corporelle. Les micropores contiennent plus d’eau du sol, ce qui est favorable aux micro-organismes et à la microfaune qui vivent dans les films d’eau recouvrant les solides du sol. Les micropores reliés aux pores du sol plus grands permettent la dispersion des micro-organismes et de la microfaune du sol dans des pores plus grands. De là, les micro-organismes et la microfaune sont transportés par les forces gravitationnelles, l’eau s’écoulant à travers les surfaces par cohésion, et les forces de tension-évapotranspiration dans d’autres compartiments, y compris la rhizosphère, la détritusphère et les couches profondes du sol. La microfaune et la macrofaune du sol habitent préférentiellement les pores humides et remplis d’air et en créent de nouveaux grâce à leurs activités de creusement et d’enfouissement. Les pores créés par les vers de terre sont appelés drilosphère (Beare et al 1995), mais nous considérons que ces macropores ont des fonctions similaires à celles d’autres crevasses de la porosphère.
La dynamique des pores est liée, en partie, à la quantité d’eau dans la matrice du sol. Par exemple, les inondations peuvent faire gonfler certains sols et occuper plus d’espace physique, en raison de l’expansion des minéraux argileux. Au fur et à mesure que l’eau s’évapore, le sol s’affaisse en un volume plus petit. La connectivité interstitielle est une autre propriété dynamique du sol qui détermine la quantité d’eau qui s’écoule verticalement et latéralement à travers la matrice du sol. Les grands pores qui dirigent l’eau verticalement contribuent à l’écoulement préférentiel de l’eau et au drainage souterrain. Les pores grands et petits conduisent l’eau latéralement dans le profil du sol, ce qui reconstitue l’eau dans la matrice du sol. Outre l’eau, les pores contiennent également de l’air qui échange entre le sol et l’atmosphère. La composition chimique de l’air du sol dépend du taux d’échange gazeux, de la consommation biologique et de la production de gaz à l’état de traces. Les racines des plantes et de nombreux animaux du sol sont des aérobies facultatifs qui ont besoin de beaucoup d’oxygène (O2) pour leurs processus cellulaires et respirent du dioxyde de carbone (CO2). Par exemple, la respiration des racines était près de 100 fois plus importante dans un sol humide bien aéré (potentiel matriciel < –200 hPa) qu’un sol inondé anoxique (–10 à –30hPa ; Uteau et coll., 2015).
La proportion d’air et d’eau dans les pores du sol est un déterminant clé de l’activité biologique et est influencée par la gestion des sols. La perturbation périodique du sol agricole par le labour modifie la structure des pores et l’activité biologique. En effet, le mélange mécanique de la structure du sol crée un réseau bien connecté de pores de petite taille (Fig. 10). La connectivité des pores dans ce sol labouré a augmenté l’échange d’air tout en fragmentant et en enterrant physiquement la litière végétale et d’autres détritus, ce qui rend le sol légèrement plus chaud et plus sec. Par conséquent, le sol labouré présentait un potentiel de réchauffement planétaire net de 26 à 31 % plus élevé qu’un système de semis direct adjacent (Mangalassery et al., 2014). Cela s’explique principalement par le flux plus important de CO2 et de méthane (CH4) provenant du sol labouré que par le système de semis direct. Cependant, la teneur en eau du sol et la biomasse microbienne étaient les principaux déterminants du flux de protoxyde d’azote (N2O)), car la production de N2O est davantage liée au potentiel redox du sol qu’aux perturbations externes. Les pores remplis d’eau ont un plus grand potentiel réducteur que les pores remplis d’air. En pratique, cela conduit les bactéries anaérobies facultatives et obligatoires à utiliser le NO3– comme accepteur d’électrons, produisant les gaz oxyde nitrique (NO), protoxyde d’azote (N2O) et diazote (N2) comme produits de réaction. Les gaz azotés qui diffusent à partir de l’écosystème du sol représentent une perte nette d’apport d’azote au sol aux plantes. De plus, le N2O est un gaz à effet de serre ayant un effet de forçage climatique élevé, par rapport au CO2. Ainsi, la perturbation du sol affectant la porosphère peut avoir des conséquences considérables sur les échanges de gaz à l’état de traces et les niveaux d’azote disponible pour les plantes dans le système plante-sol.
Conclusions
L’écosystème du sol est un environnement structuré avec des composantes abiotiques (matière organique, minéraux) et biotiques en interaction. L’activité biotique du sol dépend à la fois des autotrophes, principalement des plantes, et des hétérotrophes du réseau trophique du sol. Les principaux consommateurs du réseau trophique du sol métabolisent les substrats organiques qui sont libérés dans la rhizosphère ou libérés lors de la décomposition des détritus. La croissance et l’activité des consommateurs primaires sont liées par les consommateurs secondaires et tertiaires (prédateurs), ainsi que par les ingénieurs invertébrés qui sont responsables de la fragmentation physique de la litière grossière en fragments qui sont hydrolysés pour libérer des molécules simples et métabolisables pour le cycle biogéochimique du sol. Ces processus sont responsables du transfert d’énergie, de nutriments, d’oligo-éléments, d’eau et d’air vers d’autres écosystèmes sur terre. Des interactions sont à prévoir entre les composants biotiques, et ceux-ci sont responsables de l’autorégulation de l’écosystème du sol via des rétroactions et des mécanismes homéostatiques. La diversité et la complexité écologiques de l’écosystème du sol confèrent une stabilité, qui peut se manifester par la capacité de résister aux perturbations, mais qui permet la régénération des fonctions du sol après les perturbations, en raison de la résilience inhérente de l’écosystème du sol. Étant donné que le sol fait partie de l’écologie, il convient d’étudier la pédologie du sol et d’autres branches de la science du sol d’un point de vue écologique.
Références
Beare MH, Coleman DC, Crossley DA, Hendrix PF, Odum EP (1995). Une approche hiérarchique pour évaluer l’importance de la biodiversité du sol dans le cycle biogéochimique. Dans : Collins HP, Robertson GP, Klug MJ (eds) L’importance et la régulation de la biodiversité des sols. Développements en sciences des plantes et des sols. 63:5–22. Springer, Dordrecht. DOI : 10.1007/978-94-011-0479-1_1
Bever JD, Dickie IA, Facelli E, Facelli JM, Klironomos J, Moora M, Rillig MC, Stock WD, Tibbett M, Zobel M (2010) Théories d’enracinement de l’écologie des communautés végétales dans les interactions microbiennes. Tendances Ecol Evol 25(8) :468-478. DOI : 10.1016/j.tree.2010.05.004
Blagodatskaya E, Kuzyakov Y (2013) Microorganismes actifs dans le sol : examen critique des critères et des approches d’estimation. Sol Biol Biochem 67:192-211. DOI : 10.1016/j.soilbio.2013.08.024
Chapin FS III, Eviner VT (2014) Interactions biogéochimiques régissant la production primaire nette terrestre. Dans : Holland HD, Turekian KK (eds) Treatise on Geochemistry, 2e éd. 10:189–216. Elsevier, Oxford. DOI : 10.1016/B978-0-08-095975-7.00806-8
De la Fuente Cantó C, Simonin M, King E, Moulin L, Bennett MJ, Castrillo G, Laplaze L (2020) Un phénotype racinaire étendu : la rhizosphère, sa formation et ses impacts sur la valeur adaptative des plantes. Usine J 103(3) :951 à 964. DOI : 10.1111/tpj.14781.
Fan Y, Miguez-Macho G, Jobbágy EG, Jackson RB, Otero-Casal C (2017) Régulation hydrologique de la profondeur d’enracinement des plantes. PNAS États-Unis 114(40) :10572 à 10577. DOI : 10.1073/PNAS.1712381114
Gautrat P, Laffont C, Frugier F, Ruffel S (2021) Signalisation systémique de l’azote : de la nodulation symbiotique à l’acquisition des racines. Tendances Plant Sci 26(4) :392-406. DOI : 10.1016/j.tplants.2020.11.009
Hobbie S (2000) Interactions entre la lignine de la litière et la disponibilité de l’azote du sol lors de la décomposition de la litière de feuilles dans une forêt montagnarde hawaïenne. Écosystèmes 3:484-494. DOI : 10.1007/S100210000042
Lajtha K, Bowden RD, Crow S, Fekete I, Kotroczó I, Plante A, Simpson MJ, Nadelhoffer KJ (2018) Le réseau de traitement de l’entrée et de l’élimination des détritiques (DIRT) : aperçu de la stabilisation du carbone dans le sol. Sci Total Environ 640-641:1112-1120. DOI : 10.1016/j.scitotenv.2018.05.388.
Mangalassery S, Sjögersten S, Sparkes D, Sturrock CJ, Craigon J, Mooney SJ (2014) Dans quelle mesure le semis direct peut-il entraîner une réduction des émissions de gaz à effet de serre des sols tempérés ?. Sci Rep 4:4586. DOI : 10.1038/srep04586
Palmero F, Fernandez JA, Garcia FO, Haro RJ, Prasad PVV, Salvagiotti F, Ciampitti IA (2022) Une revue quantitative des contributions de la fixation biologique de l’azote aux systèmes agricoles par les légumineuses à grains. Eur J Agron 136:126514. DOI : 10.1016/j.eja.2022.126514.
Rosenblueth M, Ormeño-Orrillo E, López-López A, Rogel MA, Reyes-Hernández BJ, Martínez-Romero JC, Reddy PM et Martínez-Romero E (2018) Fixation de l’azote dans les céréales. Microbiol avant 9:1794. DOI : 10.3389/fmicb.2018.01794
Shane MW, Lambers H (2005) Racines de l’agrégation : une curiosité en contexte. Plant Soil 274:101-125. DOI : 10.1007/S11104-004-2725-7
Sønderholm F, Bjerrum CJ (2021) Les niveaux minimums d’oxygène atmosphérique provenant des racines d’arbres fossiles impliquent une nouvelle rétroaction plante-oxygène. Geobiol 19:250-261. DOI : 10.1111/GBI.12435
Sorensen JW, Shade A (2020) La dynamique de dormance et la dispersion contribuent à la résilience du microbiome du sol. Phil Trans R Soc B 375 : 20190255. DOI : 10.1098/rstb.2019.0255
Taktek S, St-Arnaud M, Piché Y, Fortin A, Antoun H (2017) Solubilisation de roches phosphatées ignées par des mycorrhizobactéries et des hyphobactéries formant un biofilm associées à Rhizoglomus irregulare DAOM 197198. Mycorhize 27:13-22. DOI : 10.1007/S00572-016-0726-Z
Uteau D, Hafner S, Pagenkemper SK, Peth S, Wiesenberg GLB, Kuzyakov Y, Horn R (2015) Gradients de potentiel d’oxygène et d’oxydoréduction dans la rhizosphère de la luzerne cultivée sur un sol limoneux. J Plant Nutr Soil Sci 178:278–287. DOI : 10.1002/jpln.201300624
Vivelo S, Bhatnagar JM (2019) Un signal évolutif de la succession fongique pendant la décomposition de la litière végétale. FEMS Microbiol Ecol 95(10) :fiz145. DOI : 10.1093/femsec/fiz145
Wallace A, Romney EM, Cha JW (1980) Distribution en profondeur des racines de certaines plantes vivaces dans la zone du site d’essai du Nevada du nord du désert de Mojave. Great Basin Nat Memoir 4:201-207. http://www.jstor.org/stable/23376679
Yazdanbakhsh N, Fisahn J (2010) Analyse de la cinétique de croissance des racines d’Arabidopsis thaliana avec une haute résolution temporelle et spatiale. Ann Bot 105(5) :783 à 791. DOI : 10.1093/AOB/MCQ048